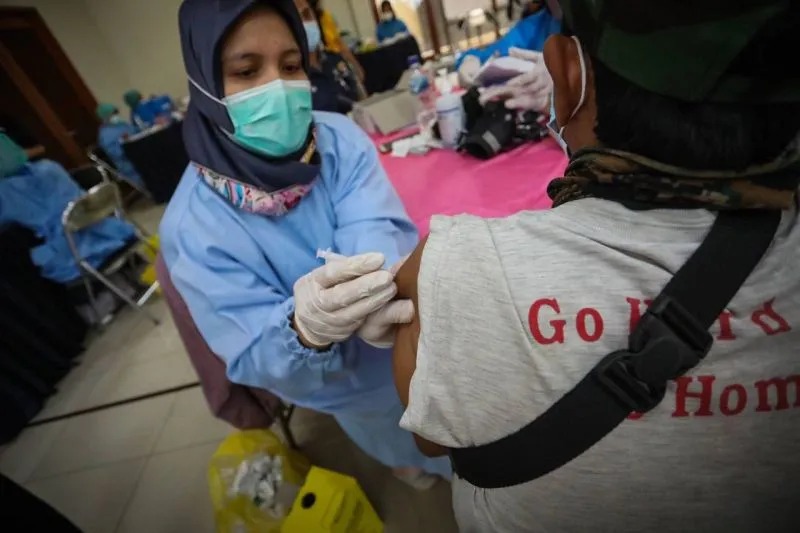
Dadali: Sejumlah masyarakat Indonesia mungkin mempertanyakan alasan di balik terbitnya izin penggunaan darurat atau emergency use authorization (EUA) terhadap vaksin Sinovac untuk lanjut usia (lansia). Pasalnya, di Indonesia saja uji klinis tahap tiga untuk vaksin Sinovac baru dilakukan untuk masyarakat dengan rentang usia 18-59 tahun.
Lantas, kenapa akhirnya Badan Pengawas Obat dan Makanan (BPOM) memutuskan untuk menerbitkan EUA untuk lansia?
Ternyata EUA yang diterbitkan mempertimbangkan hasil uji klinis vaksin Sinovac tahap kedua di Tiongkok dan tahap ketiga di Brazil. Hasil uji klinis di Tiongkok menunjukkan vaksin Sinovac dapat meningkatkan antibodi yang baik pada lansia. Mereka melakukan uji klinis ini terhadap 400 masyarakat berusia di atas 60 tahun.
Sementara, uji klinis tahap tiga di Brazil dilakukan terhadap 600 warga lansia. Hasilnya menunjukkan bahwa vaksin Sinovac aman dan tidak menimbulkan efek samping serius.
“Dari hasil studi klinis yang telah dilakukan, efek samping yang umumnya terjadi adalah ringan, seperti mual, demam, bengkak, kemerahan pada kulit, dan sakit kepala sebelah,” kata Kepala BPOM Penny Lukito dalam konferensi pers yang digelar secara virtual pada Minggu, 7 Januari 2021.
Pertimbangan-pertimbangan itulah yang akhirnya menjadi acuan BPOM untuk mengeluarkan izin penggunaan darurat untuk vaksin Sinovac bagi masyarakat lansia di Indonesia. Keputusan ini juga mencuat setelah BPOM menganalisis lebih jauh data-data uji klinis yang dilakukan di negara lain.
Penny juga menjelaskan bahwa masyarakat lansia juga akan menerima dua dosis vaksin. Tetapi, selang waktunya 28 hari, bukan 14 hari.
“Pada 5 Februari 2021, BPOM telah mengeluarkan persetujuan penggunaan otorisasi penggunaan darurat atau EUA vaksin CoronaVac untuk usia di atas 60 tahun. Dengan dua dosis penyuntikan vaksin yang diberikan selang waktu 28 hari,” ucapnya.
(SYI)